- Startseite >>
- Gesundheit >>
- Umweltbezogener Gesundheitsschutz >>
- Expositionsmessungen >>
- Humanbiomonitoring
Informationen zum Effekt-Monitoring
Einschätzung des Gesundheitsrisikos durch Effekt-Monitoring
Im Effektmonitoring werden die Wirkungen bestimmt, die durch einen Fremdstoff auftreten können. Diese Beanspruchungsparameter können eine Vielzahl von biologischen Endpunkten betreffen. Ein derartiges Monitoring und seine Beurteilung wird zurzeit noch nicht routinemäßig in der Umweltmedizin eingesetzt, sondern eher im Rahmen spezieller Fragestellungen in Forschungsprojekten durchgeführt. Allerdings empfiehlt die Human-Biomonitoring-Kommission neuerdings, stärker als bisher bei entsprechenden Fragestellungen Hämoglobinaddukte als Biomarker von Beanspruchungen durch gentoxische Substanzen einzusetzen. Allgemein verbindliche Beurteilungskriterien liegen derzeit nicht vor. In der Regel werden Gruppen mit einer bestimmten Exposition mit einer Kontrollgruppe verglichen, bei der keine besondere Exposition vorhanden ist (Hintergrundbeanspruchung). DNA-Addukte in peripheren Lymphozten, die häufig als Ersatz für die schwer zugänglichen Zielgewebe der biologischen Wirkung (z. B. Leber, Niere, Lunge etc.) dienen, werden immer häufiger untersucht. Denn man geht davon aus, dass eine Vielzahl von krebserzeugenden Substanzen ihre biologische Wirkung durch kovalentes Binden an zelluläre DNA entfaltet [Vainio 2001]. Die Fragen die sich mit der Interpretation der Untersuchungsergebnisse von DNA-Addukten ergeben, sind vielfältig:
- Was ist als niedrige Belastung anzusehen?
- Was zeigt eine durch Schadstoffe induzierte Erhöhung der DNA-Addukt-Menge an? Lässt sich daraus das Risiko quantitativ einschätzen?
- Ab welchem Addukt-Niveau ist mit einem biologischen Effekt zu rechnen?
Eine Expertengruppe hat sich mit diesen Fragen beschäftigt und zog folgende Schlüsse:
Mögliche gesundheitsschädliche Folgen der DNA-Addukte können Mutationen in Soma- oder Keimzellen, Zellalterung und Krebs z. B. infolge von Mutationen in Onkogenen oder Tumorsuppressorgenen sein. Als niedrige Belastung gilt in der Zwischenzeit 1 Addukt pro 109 bis 1010 Nukleotide. In allen Zellen treten üblicherweise Addukte auch ohne besondere Belastung auf (Hintergrundbelastung). Ein Addukt in 108 Nukleotiden scheint die Reparatursysteme für Addukte zu induzieren. Der Schaden wird repariert, und es entsteht keine Mutation. Folglich gilt der Nachweis von Addukten allein nicht als Beweis für eine Mutation. Niedrige Addukt-Mengen bedeuten zwar ein niedrigeres Risiko im Vergleich zu hohen Adduktmengen; da es aber keinen "Addukt-Schwellenwert " gibt, bei dessen Überschreitung von einer biologischen Wirkung ausgegangen werden kann, lässt sich das Risiko bei den verschieden hohen Adduktbeanspruchungen nicht quantifizieren [Pottenger et al. 2004].
An den folgenden Beispielen werden verschiedene Möglichkeiten des Effekt-Monitorings vorgestellt:
Beispiel 1: Tabakrauch / Passivrauchen
Tabakrauch ist ein systemisch kanzerogen wirkendes Stoffgemisch. Er ist nicht nur Hauptverursacher des Lungenkrebses, sondern wird mit weiteren 11 Krebsarten in ursächlichen Zusammenhang gebracht. Etwa 90% der Lungenkrebsfälle sind mit Rauchen assoziiert. Weitere Tumorlokalisationen sind die Nasen(neben)höhle, der Hypopharynx, der Ösophagus, der Magen, die Bauchspeicheldrüse, die Leber, die Nieren, der Harnleiter, die Harnblase, die Zervix und das Knochenmark [IARC 2004]. Im Tabak wurden mehr als 50 erbgutverändernde und krebserzeugende Substanzen nachgewiesen wie z. B. polyzyklische aromatische Kohlenwasserstoffe, Aldehyde, Metalle, Ethylenoxid, Acetamid, Vinylchlorid, Butadien, Nitrosamine, aromatische und heterozyklische Amine.
- Tabelle 1: (PDF, 8KB): krebserzeugende Verbindungen im Hauptstrom des Zigarettenrauchs und ihre Einstufung nach IARC (2004).
- Tabelle 2 : (PDF, 46KB): Auswahl genotoxischer Effekte, die bei Rauchern oder Passivrauchern im Vergleich zu Nichtrauchern in zahlreichen wissenschaftlichen Studien an Erwachsenen, Neugeborenen oder Krebspatienten festgestellt wurden.
- Erläuterungen zu den genotoxischen Effekten (PDF , 108KB) - Anhang 1 (nach [Fahrig 1993, Neumann 2004])
Anlage 2:
Graphische Darstellung von Schwesterchromatidaustauschen
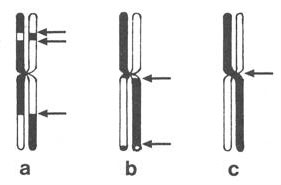
a: drei SCE (s. Pfeile)
b: SCE in Nähe Zentromer
c: Überschlagung der Chromatiden am Zentromer
nach Fahrig (1993)
Im Blut von Rauchern konnte als Folge der Hämoglobinadduktbildung des Ethylenoxdis Hydroxyethylvalin und Cyanoethylvalin bestimmt werden. Dabei werden die alkylierten N-terminalen Valine des Hämoglobins abgespalten, diese Spaltprodukte derivatisiert und mit GC/MS analysiert [DFG 1996]. Beim Nichtraucher treten diese Verbindungen nicht bzw. in ganz geringen Mengen auf [Bader et al. 1995, Neumann et al. 2003]. In Abbildung 1 sind die Untersuchungsergebnisse für erwachsene Raucher, Nichtraucher und Passivraucher im Alter von 17 bis 84 Jahren graphisch dargestellt. Die Rauchergruppe zeigten den höchsten Mittelwert mit 372 ± 242 pmol/g Hb. Nichtraucher hatten einen Mittelwert von 45 ± 62 pmol/g Hb, Passivraucher von 174 ± 121 pmol/g Hb. Der Unterschied zwischen Rauchern und Nichtrauchern bzw. Rauchern und Passivrauchern war hochsignifikant. In der Rauchergruppe korrelierte die Höhe der Cynanoethylvalinadduktmenge mit der Angabe über die gerauchte Anzahl der Zigaretten pro Tag [Zwirner-Baier et al. 2003].

Abbildung 1: N-Cyanoethylvalin-Addukte (CEV) bei erwachsenen Rauchern, Nichtrauchern und Passivrauchern (Box enthält 50% der Werte; der Balken oben ist begrenzt durch die 95te Perzentile, der Balken nach unten durch die 5te Perzentile; Balken in der Box ist der Mittelwert) [Zwirner-Baier et al. 2003]
Außerdem bindet 4-Aminobiphenyl, ein aromatisches Amin, an Hämoglobin. Dieses gebundene Amin wird durch sauere Hydrolyse in der Untersuchung wieder freigesetzt, anschließend derivatisiert und mittels GC/ECD gemessen [DFG 1994]. Kinder aus Raucherhaushalten hatten signifikant höhere Hämoglobin-Addukt-Gehalte als Kinder aus Nichtraucherhaushalten (Mittelwerte 82,2 bzw. 60.6 pg/g Hb) (Abbildung 2). Auch die Mikrokernrate war bei Kindern aus Haushalten mit Rauchern statistisch signifikant erhöht (Mittelwerte: 8 pro 1000 doppelkernige Zellen bei Raucherhaushalten; 6,2 pro 1000 doppelkernige Zellen bei Nichtraucherhaushalten) (Abbildung 3). Mikrokerne sind ein biologischer Effekt-Monitoring-Marker, der durch eine Chromosomenfehlverteilung während der Mitose entstehen [Baier et al. 2002].
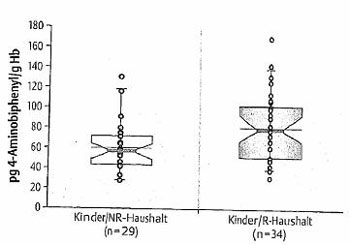
Abbildung 2: 4-Aminobiphenyl-Adduktspiegel bei Kindern aus Raucher- und Nichtraucherhaus-halten
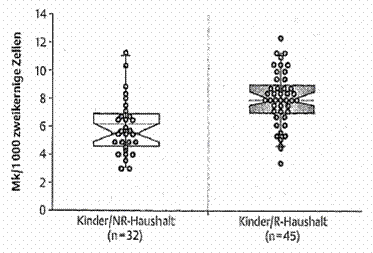
Abbildung 3: Mikrokernraten (MK/1000 zweikernige Zellen) bei Kindern aus Raucher- und Nichtraucher-haushalten
Die Stoffwechselwege der potentiellen Kanzerogene, die zur Bildung reaktiver Metabolite und dann zum jeweiligen Addukt führen, sind im Anhang 3 angefügt: Stoffwechsel Ethylenoxid und Stoffwechsel aromatische Amine: PDF, 96KB zum Download
Beispiel 2: Umweltkontamination durch Erzabbau in Mexiko
In einer Region in Mexiko namens Villa de la Paz wird seit 100 Jahren arsen- und bleihaltiges Erz abgebaut. Die Bodenbelastungen liegen für Blei im Durchschnitt bei ca. 750 mg/kg und für Arsen bei ca. 2460 mg/kg. Hausstaubwerte für Blei wurden in Höhe von ca. 950 mg/kg bzw. für Arsen in Höhe von ca. 2230 mg/kg festgestellt. Human-Biomonitoring-Untersuchungen wurden bei zwanzig drei bis sechsjährigen Kindern, die mindestens seit zwei Jahren in dieser Region lebten und einer Kontrollgruppe (n= 35) durchgeführt. Die Bleibelastung der Kinder wurde im Blut und die Arsenbelastung im Urin bestimmt. Zudem wurden im Rahmen des Effektmonitorings Einzel- oder Doppelstrangbrüche einzelner Zellen im Comet-Assay bestimmt. Im Comet-Assay werden periphere Lymphozten auf dem Objekträger in Agarose eingebettet und anschließend lysiert. Im Zuge der Mikroelektrophorese auf dem Objektträger treten die Bruchstücke aus der Zelle aus, wandern entsprechend ihrer Landung und Größe und bilden eine durch Anfärbung sichtbar zu machenden "Kometenschweif " (im englischen tail) (siehe Abbildung 4). Ausgewertet wird die Länge des Kometen und das "tail moment " (Produkt aus Komentenlänge und der im Schweif enthaltenen DNA-Menge) [Neumann et al. 2004]. Die Untersuchungsergebnisse der Kinder sind in der folgenden Tabelle 3 wiedergegeben.
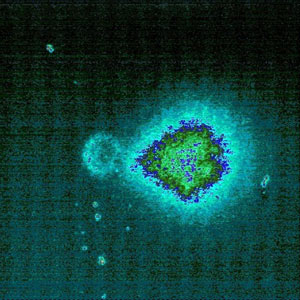
Abbildung 4 : Aufgenommen bei 400-facher Vergrößerung mit Ethidiumbromid-Fluoreszenz nach Grün-Anregung bei 515-560 nm (mit freundliche Genehmigung von Sebastian Nehls)
|
Test |
Geometrischer Mittelwert |
|
|---|---|---|
|
Kinder exponiert |
Kinder Kontrolle |
|
| Arsen Urin (µg/g Kreatinin) | 136 | 34 |
| Blei Blut (µg/l) | 116 | 83 |
| Komet Länge (µm) | 67,6 | 41,7 |
| tail moment | 6,8 | 3,2 |
Die "exponierten " Kinder hatten deutlich höhere Blei- und Arsenbelastungen. Die Anzahl der Kinder mit Blutbleiwerten über 150 µg/l (dem HBM II - Wert) war 4mal höher in der exponierten Gruppe im Vergleich zur Kontrollgruppe. Zudem hatten die Kinder aus Villa de la Paz mehr Einzel- und Doppelstrangbrüche [Yanez et al. 2003].
| DNA-Addukt | Produkt der kovalenten Bindung von reaktivem Zwischenprodukt des Schadstoffs mit der DNA. Angriff erfolgt an verschiedensten Positionen der Basen. |
| Oxidativer Stress | Verursacht DNA-Strangbrüche und Mutationen durch Bildung von Sauerstoffradikalen, H202 und Minimierung von Reparaturmechanismen |
| Schwesterchromatidaustausch (SCE) | Entstehung durch reziproken Austausch von DNA zwischen beiden Schwesterchromatiden; Normalrate 7-10 SCE/periphere Lymphoztenzelle; sichtbar durch Einbau von 5-Bromdesoxyuridin. |
| Chromosomenaberration | DNA Doppelstrangbruch; sie können ein Schwesterchromatid des Chromosoms oder beide betreffen; im Mikroskop zeigen gefärbte Chromosomen Brüche, Umlagerungen, dizentrische und ringförmige Strukturen. |
| Aneuploidie | Abweichung von der normalen Chromosomenzahl |
| HPRT Genmutation | Gen codiert für Hypoxanthin-Guanin-Phosphoribosyl-Transferase; Indikatorgen für Mutationen in menschlichen Blutzellen; durchschnittliche Mutationsfrequenz: 5 x 10-6. |
| Mikrokern | Entstehung durch Kondensation von Chromosomen/Chromosomenfragmenten; als kleine zusätzliche Kerne im Mikroskop sichtbar; Spontanrate schwankt zwischen 3 bis 23 Mikrokernen pro 1000 Zellen. |
| p53 Genmutation | Gen codiert für Tumorsuppressorprotein, das Zellzklus arretiert, DNA-Reparatur beeinflusst, wirkt im Zellkern. |
| K Ras Genmutation | Gen codiert Protoonkogen, das in Signaltransduktion involviert ist, wirkt im Zellkern. |

